酸と塩基
1. 基礎的な実験;
1) 酸・アルカリと指示薬;
* ビ−カ−に水を半分ほど入れ、指示薬のチモ−ルブル−(TB)溶液を数滴加えると黄色に色づく(中性・2.8<pH<8.0)。これに、10%塩酸を一滴加えると赤色に変色する(酸性・pH<1.2)。次に、5%水酸化ナトリウムを2〜3滴加えると青色に変わる(アルカリ性・pH>9.6)。
また、ブロムチモ−ルブル−(BTB)では、酸性(ph<6.0)の時黄色、中性の時緑色(変色の範囲は狭い)、アルカリ性(ph>7.6)の時青色になる。
(酸・アルカリを交互に加えることにより、何度でも繰り返して変色する。)

また、フェノ−ルフタレイン(PP)では、強アルカリ性の苛性ソ−ダNaOHや炭酸ソ−ダNa2CO3では変色して赤色になるが、弱アルカリ性の重曹NaHCO3では無色のままである。(苛性ソ−ダの薄い溶液にフェノ−ルフタレインを加え濾紙に染み込ませて空気中に放置しておくと、空気中の炭酸ガスを吸収して次第に重炭酸ソ−ダになるので、赤色が無色に変わる。)
2) 酸・アルカリの強弱;
* 酢酸に水酸化ナトリウム溶液を等量加えると酸臭が消える。
CH3COOH(酢酸)(・・弱酸) + NaOH = CH3COONa + H2O
これにより強い酸である硫酸(または塩酸)を加えて加熱すると、弱い酢酸が追い出され再び酢酸臭が発生する。
2CH3COONa + H2SO4(・・強酸) = 2CH3COOH + NaSO4
同様に、アンモニア水に硫酸を加えるとアンモニア臭が消えるが、これに水酸化ナトリウムを加え加熱すると再びアンモニアが発生する。(リトマス紙を青変させる。)
* 亜鉛を試験管に取り、塩酸を入れると水素が発生するが、クエン酸溶液(あるいはレモン液)ではほとんど発生しない。次に、マグネシウムに塩酸を注ぐと非常に激しく水素が発生し、クエン酸溶液(あるいはレモン液)でもかなり水素が発生するが塩酸ほどではない。(卵の殻や大理石(炭酸カルシウム)に注いでも、同じように違いがわかる。この場合二酸化炭素(炭酸ガス:炭酸はきわめて弱い酸)が発生する。)
* 少量のホウ酸粉末に水酸化ナトリウムを加え緩やかに加熱するとホウ酸は溶解して液が透明になる。(冷却しても透明。)これに、塩酸を加えると再びホウ酸が遊離して沈殿してくる。
* 水ガラス(珪酸ナトリウム水溶液)を蒸発皿に取り、しばらく空気中で放置すると、空気中の炭酸ガスを吸収して炭酸ナトリウムを生じ、珪酸が遊離してゲル状の水和物になり固まる。
2. 水素イオン濃度(pH値)の説明;
水溶液の酸性・アルカリ性は、液中で電離している水素イオンH+の濃度によって決まる。その一般的な表し方として、pH(ペ−ハ−)という値を用いる。
pH = 14 ― log(〈 H+〉/〈H2O〉(水素イオン濃度))
たとえば、塩化水素HClは水溶液中でH+とCl-に電離して、〈H+〉/〈H2O〉の値が10の14乗になったとすると、その溶液のpHは1になる。
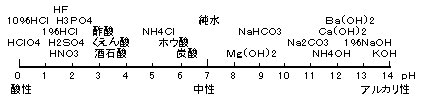
水そのものは、H+/H2Oは10の‐7乗で、pH=7
逆に、水酸化ナトリウムNaOHを水に溶かすと、Na+とOH-に電離し、〈OH-〉/〈H2O〉の値が10の14乗になったとすると、log(〈H+〉/〈H2O〉)= 14 ― log(〈OH-〉/〈H2O〉) = 14 ― 14 = 0 となり、pH=14になる。
大体、塩酸や硫酸などの鉱酸は電離度が大きく強酸性、酢酸などの電離しにくい有機酸は弱酸性である。MgやCaなどの難溶性の水酸化物や緩衝効果のあるNaHCO3は弱アルカリ性、水酸化ナトリウムなどの苛性アルカリは強アルカリ性である。
3. 中和滴定;
強酸と強アルカリの中和の場合、それぞれから取り残されたH+(正式にはH3O+)とOH-が結合して電離度の低い水分子になるので、中和点はほぼpH7になる。しかし、酸アルカリの強さのバランスが異なるものどうし(強酸と弱アルカリ、弱酸と強アルカリ)では、強いほうのイオンが残された水分子の幾らかををH+またはOH-に電離させるので、それぞれの強いほうにpHが引っ張られる。
その為、等量の酸およびアルカリが中和したとしてもその中和点はpH=7であるとはかぎらないから、使用する指示薬はそれぞれの中和点近辺で変色するものを選定すべき事に注意しなければならない。
(指示薬の使用例)
強酸・強塩基・・・ブロムチモ−ルブル−(黄6.0−7.6青)など使用、変化が急峻なのでリトマスも使える
強酸・弱塩基・・・メチルオレンジ(赤3.1−4.4黄)、チモ−ルブル−の酸性側(赤1.2−2.8黄)など使用
弱酸・強塩基・・・フェノ−ルフタレイン(無色8.3−10.0赤)など使用
弱酸・弱塩基・・・ブロムチモ−ルブル−(黄6.0−7.6青)など使用、変化がゆるやかなのでリトマスは使えない


(実験例);
* 1N塩酸(強酸・一価)によるアンモニア(弱塩基・一価)の滴定;
・ 反応式は、HCl + NH4OH = NH4Cl + H2O
・ ゴム帽付きホ−ルピペットまたは駒込ピペットで、約10%アンモニア水を正確に5ml秤り取り、200mlのコニカルビ−カ−に入れ、水(純水が望ましい)約
50mlで希釈する。
・ これにメチルオレンジ(指示薬)を数滴加える。(黄色、ビ−カ−の下に白い紙を敷くと見やすい。)
・ ビュレットから0.1NHCl(1N塩酸をホ−ルピペットとメスフラスコを用いて純水で正確に1/10に希釈する)を滴下し、反応の終点近くではよくビ−カ−を回すようにして攪拌しつつ注意深く行う。
・ メチルオレンジが黄色から赤色に変わった所が反応の終点であり、この時の0.1NHClの消費量L(0.1NHCl)(ml)を読み取る。
・ 求めるアンモニア水の濃度C(NH3)は、
C(NH3) = 0.1*L(0.1NHCl)/ 5 (M/l)
この値にアンモニアの分子量17を乗じれば(g/l)、さらに10で割れば(%)の値になる。
* 多価酸による苛性アルカリ(一価)の中和;
電離する水素が二個以上の酸の場合、その水素イオンの解離も複数の段階を経る。たとえば、
硫酸: H2SO4 = H+ + HSO4-(硫酸水素イオン)
= 2H+ + SO4 2-(硫酸イオン)
正リン酸: H3PO4 = H+ + H2PO4-(第一リン酸イオン)
= 2H+ + HPO4 2-(第二リン酸イオン)
= 3H+ + PO4 3-(第三リン酸イオン)
したがって、中和点も価数分存在し、それぞれに合う指示薬を用意しなければならない。
戻る



